Cette fiche est destinée à vous informer  sur la maladie de Lyme. Elle ne se substitue pas à une consultation médicale. Elle a pour but de favoriser le dialogue avec votre médecin. N’hésitez pas à lui faire préciser les points qui ne vous paraîtraient pas suffisamment clairs et à demander des informations supplémentaires sur votre cas particulier. En effet, certaines informations contenues dans cette fiche peuvent ne pas être adaptées à votre cas : il faut se rappeler que chaque patient est particulier. Seul le médecin peut donner une information individualisée et adaptée.
sur la maladie de Lyme. Elle ne se substitue pas à une consultation médicale. Elle a pour but de favoriser le dialogue avec votre médecin. N’hésitez pas à lui faire préciser les points qui ne vous paraîtraient pas suffisamment clairs et à demander des informations supplémentaires sur votre cas particulier. En effet, certaines informations contenues dans cette fiche peuvent ne pas être adaptées à votre cas : il faut se rappeler que chaque patient est particulier. Seul le médecin peut donner une information individualisée et adaptée.
Les informations rapportées ici sont issues de l’Encyclopédie Orphanet Grand Public de mars 2008 –
www.orpha.net/data/patho/Pub/fr/Lyme-FRfrPub12159v01.pdf – (document réalisé par Orphanet avec la collaboration du Pr Daniel Christmann, service des maladies infectieuses et tropicales, CHU Hôpital Civil – Hôpitaux universitaires de Strasbourg, Strasbourg).
Qu’est-ce que la maladie de Lyme ?
La maladie de Lyme est une maladie infectieuse due à une bactérie (Borrelia, dont il existe plusieurs espèces) transmise à l’homme par l’intermédiaire d’une piqûre de tique. Cette maladie peut toucher plusieurs organes, principalement la peau, les articulations et le système nerveux.
Bien que déjà observée depuis de très nombreuses années en Europe, cette maladie a été décrite en 1975 suite à de nombreux cas d’arthrite (inflammation des articulations) chez des enfants et des adultes dans une ville du Connecticut aux Etats-Unis (Lyme).
Combien de personnes sont atteintes de la maladie ?
La prévalence (nombre de personnes atteintes dans une population donnée) et l’incidence (nombre de nouveaux cas par an dans une population donnée) sont différentes suivant les régions du monde. Aux Etats-Unis, la prévalence se situe entre 1 personne atteinte sur 12 000 et 1 sur 17 000.
En France, l’incidence est mal connue et varie d’une région à l’autre. L’incidence moyenne serait de l’ordre de 1 nouveau cas et pour 6 000 habitants par an. Il semblerait toutefois que de nombreux cas ne soient pas diagnostiqués.
Qui peut en être atteint ? Est-elle présente partout en France ?
Cette maladie peut toucher les personnes de tout âge. Cependant, elle atteint préférentiellement les adultes jeunes (travailleurs en forêt, randonneurs, etc.)
Elle est présente sur tous les continents, mais elle est plus répandue dans les régions tempérées et froides de l’hémisphère Nord (de l’Amérique du Nord à la Chine). En effet, les tiques sont plus nombreuses dans les régions boisées. Elle est présente en Europe et en France et plus particulièrement dans les régions de l’est.
A quoi est-elle due ?
La maladie de Lyme est due à une infection par une bactérie appartenant à la famille des Borrelia. Borrelia burgdorferi (B. burgdorferi) semble actuellement la seule souche aux USA. En Europe en plus de B. burgdorferi, d’autres souches de Borrelia peuvent être responsables de la maladie de Lyme avec des symptômes un peu différents (B. garinii, B. afzelii, B. spielmanii, B. valaisiana,…).
Cette bactérie est transmise à l’homme par l’intermédiaire d’une piqûre de tique infectée. Le taux de contamination des tiques est variable d’une région à l’autre, et parfois au sein d’une même région, allant de 5 à 35 %, par conséquent une piqûre de tique n’entraîne pas obligatoirement une maladie de Lyme.
Les tiques qui, appartiennent au genre Ixodes, se contaminent en parasitant les animaux sauvages et domestiques (elles se nourrissent du sang de ces animaux) qui sont les principaux réservoirs de cette bactérie : les rongeurs, le gros gibier (cerfs, etc.…) et les oiseaux dans une moindre mesure, ainsi que les animaux domestiques (chien, cheval…). La plupart de ces animaux ne développent pas la maladie. La tique ainsi infectée peut donc transmettre la bactérie à l’homme lors d’une piqûre.
Lors de la piqûre, la bactérie se distribue dans la peau puis dans le sang et les tissus. Il faut savoir qu’une personne infectée suite à une piqûre de tique, ne développe pas forcément la maladie. Par ailleurs, plus la durée de fixation de la tique est longue (en particulier au delà de 24 heures) plus le risque de transmission est grand. L’homme contracte principalement la maladie du printemps à l’automne, lors de balades en forêt, lorsque les tiques ou les nymphes (jeunes tiques) sont nombreuses.
Est-elle contagieuse ?
Non, il n’y a pas de cas de contamination interhumaine.
Quelles en sont les manifestations ?
On distingue trois phases dans l’évolution de la maladie.
La phase primaire
Elle apparaît environ 2 à 32 jours après la piqûre de tique et la principale manifestation est une lésion au niveau de la peau appelée érythème chronique migrant (ou érythème migrant) (Figure 3) qui se situe au niveau de la piqûre de tique. Il s’agit d’un « halo » rouge qui s’étend lentement de façon centrifuge (du centre vers la périphérie) alors que le centre s’éclaircit. Son diamètre peut varier de 3 à à plusieurs dizaines de centimètres (en moyenne 15 cm).
Cette rougeur (érythème) n’est pas douloureuse et disparaît spontanément en quelques semaines. Elle n’est pas toujours présente (dans 30 à 50 % des cas) ou peut passer inaperçue. Exemple d’érythèmes migrants (
http://www.tiquatac.org)
D’autres manifestations peuvent être associées à cette rougeur, comme une fièvre modérée, de la fatigue (asthénie), des douleurs musculaires (myalgies) et des maux de tête (dans 25 % des cas environ).
LA Phase secondaire
Dans un deuxième temps, la bactérie peut disséminer par voie sanguine et entraîner des complications, en l’absence de traitement. Des manifestations au niveau de la peau (cutanées), des articulations (articulaires), du système nerveux (nerveuses), ou du cœur (cardiaques) peuvent apparaître. Ces manifestations surviennent quelques jours à quelques semaines après la phase primaire mais sont parfois présentes en même temps que l’érythème chronique migrant.
Cette phase peut guérir spontanément ou évoluer vers la phase suivante. Il faut savoir que les diverses manifestations décrites ci-dessous ne sont généralement pas toutes présentes chez une même personne.
Les manifestations cutanées
Les manifestations cutanées sont principalement l’érythème chronique migrant multiple qui peut être présent sur tout le corps et évoluer par poussées. Il s’agit d’une atteinte fréquente aux USA, rare en Europe.
Un lymphocytome cutané bénin peut également survenir à ce stade. Il s’agit d’une petite lésion saillante de la peau (nodule) de 1 à 2 cm de diamètre et rouge-violacé siégeant principalement sur le lobe de l’oreille (Figure 4), le mamelon, le scrotum.
Les manifestations articulaires
Il s’agit de douleurs au niveau des articulations (arthralgies) ; la douleur peut durer plusieurs jours et toucher une ou plusieurs articulations.
Des inflammations articulaires (arthrites) peuvent également se manifester plus tardivement. Elles touchent principalement les grosses articulations (genoux, épaules,…) et évoluent par poussées. Elles peuvent guérir spontanément.
Les manifestations nerveuses
Des signes nerveux peuvent également survenir et ils sont assez variés : maux de tête (céphalées), douleurs le long des trajets des nerfs (névralgies), atteinte des racines des nerfs (radiculite hyperalgique, « radiculite à tiques ») qui donne de fortes douleurs qui ne cèdent pas avec les médicaments habituels contre la douleur (antalgiques), paralysie faciale (paralysie des muscles d’une moitié du visage) (Figure 5), méningite lymphocytaire (inflammation des enveloppes du cerveau), …..
Les manifestations cardiaques
Certaines personnes peuvent également présenter des problèmes cardiaques, essentiellement des troubles du rythme ou de conduction (palpitations, ralentissement du rythme des battements) et plus rarement une inflammation de l’enveloppe du cœur (péricardite) ou une inflammation du muscle cardiaque (myocardite).
Ces manifestations sont intermittentes et guérissent souvent spontanément.
Les manifestations oculaires
Plus rarement, une atteinte des yeux survient et elle peut se caractériser par une inflammation de la conjonctive (conjonctivite), responsable d’une rougeur de l’œil. Une inflammation de la cornée (kératite) ou une inflammation de l’uvée (uvéite) peuvent également survenir et être à l’origine d’un œil rouge, de douleurs, de larmoiements, d’intolérance à la lumière (photophobie) et d’une possible baisse de vision.
La phase tertiaire
La phase tertiaire ou tardive de la maladie de Lyme correspond à une évolution chronique des symptômes. Cette situation est moins fréquente, s’observe en l’absence de traitement après quelques mois à quelques années. Les principales manifestations de cette phase sont cutanées, articulaires et nerveuses.
Les manifestations cutanées
Les manifestations cutanées de la phase tardive de la maladie de Lyme sont caractérisées par l’acrodermite chronique atrophiante, également appelée maladie de Pick-Herxheimer.
Cette maladie apparaît plusieurs années après la contamination et se traduit par une lésion violacée et gonflé qui se situe principalement sur le dos des mains, aux coudes, aux chevilles, aux genoux, ou sur un segment du membre (jambe)…
Il évolue ensuite vers une atrophie cutanée : la peau devient mince et fripée et laisse apercevoir les veines en transparence.
Les manifestations articulaires
Dans la phase tardive, l’arthrite devient chronique et touche principalement les grosses articulations. Elle occasionne des douleurs durables avec des anomalies à la radiographie.
Les manifestations nerveuses
Elles peuvent donner une atteinte du cerveau (encéphalopathie chronique) avec des troubles psychiatriques ou neurologiques divers.
Quelle est son évolution ?
Comme vu précédemment, l’évolution de la maladie de Lyme peut se faire schématiquement en trois phases. Cependant, même en l’absence de traitement, elle évolue peu souvent vers la phase tertiaire.
Le pronostic de cette maladie est favorable lorsqu’elle est convenablement traitée.
Le diagnostic
Comment fait-on le diagnostic de la maladie de Lyme ? En quoi consistent les tests diagnostiques et les examens complémentaires ? A quoi vont-ils servir ?
Les médecins font le diagnostic après avoir examiné, la personne atteinte et grâce à un interrogatoire précis : présence du « halo rouge » (érythème chronique migrant), souvenir d’une piqûre de tique, …
Ce diagnostic peut être difficile à faire quand il n’y a pas eu l’érythème chronique migrant et que la piqûre de tique est passée inaperçue. De plus les symptômes de cette maladie sont très variés et peuvent faire penser à de nombreuses autres maladies.
La numération formule sanguine (NFS) ou hémogramme est le plus souvent normale ainsi que la vitesse de sédimentation qui est peu élevée.
La NFS est un examen réalisé par prise de sang qui permet de mesurer le nombre d’éléments de chacune des trois catégories de cellules sanguines que sont les globules rouges (hématies), les globules blancs (leucocytes) et les plaquettes.
La vitesse de sédimentation est le temps nécessaire aux éléments cellulaires sanguins (globules blancs, globules rouges et plaquettes) pour sédimenter au bas d’une colonne de sang incapable de coaguler (grâce à l’anticoagulant utilisé pour le prélèvement). C’est un élément d’orientation diagnostique, non spécifique mais simple à réaliser, influencé par le nombre de globules rouges et leur volume, le taux de certaines protéines, la viscosité du sang. Cette vitesse de sédimentation est élevée dans divers processus inflammatoires.
Afin de préciser le diagnostic, il est possible de réaliser des examens (sérologie de Lyme) pouvant mettre en évidence dans le sang des anticorps montrant une réponse de l’organisme à l’infection bactérienne. Un certain nombre de techniques sont utilisées mais elles ne sont pas standardisées et les résultats sont parfois difficilement interprétables. Le résultat est souvent négatif dans la première phase de la maladie et positif dans les phases secondaires et tertiaires. Cependant une sérologie positive peut correspondre à une infection ancienne mais non évolutive (c’est-à-dire que la personne a contracté l’infection mais la maladie n’évolue plus). Par ailleurs, il est possible dans quelques cas que la sérologie soit négative alors même qu’il y a eu infection.
Un examen par PCR (Polymerase Chain Reaction), technique, qui permet de mettre en évidence l’ADN (patrimoine génétique) de la bactérie, peut également être réalisée dans certaines situations.
En cas d’atteinte du système nerveux, la recherche d’anticorps dans le liquide qui entoure le cerveau (liquide céphalo-rachidien) par ponction lombaire peut (dans le bas du dos) aider à poser le diagnostic.
Peut-on confondre cette maladie avec d’autres ? Lesquelles ? Comment faire la différence ?
Les symptômes de cette maladie sont assez variés ce qui peut rendre le diagnostic difficile.
Les manifestations cutanées présentes lors de la phase primaire ou secondaire peuvent être confondues avec d’autres problèmes tels qu’une mycose (infection de la peau due à un champignon) ou une réaction inflammatoire à une piqûre d’insecte…
La maladie de Lyme peut également être confondue avec d’autres pathologies telles que le lupus, les infections virales, la sclérose en plaques, la fibromyalgie…
Le traitement, la prise en charge, la prévention
Existe-t-il un traitement pour cette pathologie ? Quels bénéfices attendre du traitement ? Quels sont les risques du traitement ?
Oui, il existe un traitement curatif de cette maladie qui repose sur la prise d’antibiotiques. Plus ce traitement antibiotique est administré rapidement, plus il est efficace. Les doses, ainsi que le type d’antibiotiques sont à adapter au stade et aux manifestations de la maladie.
Dans la phase primaire de la maladie (traitement de l’érythème chronique migrant), le traitement repose sur l’administration d’antibiotiques de la classe des Bêta-lactamines (principalement amoxicilline) ou des cyclines pendant deux à trois semaines. Ces antibiotiques ont une bonne diffusion dans les tissus ce qui permet d’atteindre les zones infectées, le but étant de faire disparaître les symptômes et de prévenir l’apparition des manifestations tardives.
Dans les phases tardives, les céphalosporines dites de 3ème génération peuvent être utilisées, mais doivent être administrées par voie intraveineuse (patients hospitalisés). Ils permettent l’atténuation voire la disparition des symptômes.
Ces antibiotiques sont habituellement bien tolérés mais peuvent parfois être à l’origine, dans de rares cas, d’allergies.
Les macrolides ou tétracyclines peuvent également être utilisés, notamment en cas d’allergies aux précédents antibiotiques. Ils présentent cependant certains effets secondaires : problèmes digestifs, problèmes de sensibilité accrue au soleil (photosensibilité), interactions médicamenteuses et sont, pour certains, contre-indiqués chez les femmes enceintes et les enfants.
Les arthrites chroniques qui ne sont pas soulagées par le traitement antibiotique, peuvent être traitées par synoviorthèse (traitement d’une affection inflammatoire articulaire, à l’aide d’une injection de produit faite dans l’articulation) ou synovectomie (enlèvement chirurgical de la synoviale (membrane qui tapisse l’intérieur des articulations) au niveau des articulations atteintes).
A l’heure actuelle, il existe une certaine « standardisation » au niveau de la prise en charge de cette maladie avec des recommandations qui ont été proposées à la Conférence de Consensus de décembre 2006.
Un soutien psychologique est-il souhaitable ?
Dans les cas où la maladie devient chronique, un soutien psychologique peut être utile car cette maladie peut être à l’origine de douleurs permanentes et de symptômes multiples et variés qui peuvent avoir un certain retentissement sur la vie sociale. De plus, étant souvent difficile à diagnostiquer les personnes atteintes se sentent souvent incomprises.
Comment se faire suivre ?
Dans un service hospitalier de maladies infectieuses, de dermatologie, de rhumatologie, de neurologie ou de médecine interne en fonction des symptômes.
Peut-on prévenir cette maladie ?
Oui, on peut prévenir cette maladie en prenant des précautions dans les zones à risque (zones où les tiques sont présentes). Ces précautions consistent dans le port de vêtements couvrants au niveau des jambes, des bras et du cou et l’utilisation de produits répulsifs lors de promenades ou de travaux en forêt.
Il est ensuite important de s’inspecter soigneusement à la recherche de tiques afin de les enlever. L’extraction de la tique doit se faire le plus rapidement possible en la prenant au plus près de la peau grâce à une pince et sans oublier la tête. Il est ensuite conseillé de désinfecter la zone. Par contre, il est déconseillé d’utiliser de l’éther au moment de l’extraction de la tique.
Par ailleurs, les personnes ayant des animaux domestiques (chats, chiens, chevaux…) peuvent utiliser en prévention des poudres anti-tiques afin de traiter ces animaux et leur environnement.
En cas de piqûre de tique, il n’est pas nécessaire de donner un traitement antibiotique en prévention (antibiothérapie prophylactique) car, comme énoncé précédemment, toutes les tiques ne sont infectées par la bactérie et une personne piquée par une tique infectée ne développe pas forcément la maladie.
Par contre, une antibiothérapie prophylactique peut être recommandée aux femmes enceintes. En effet, si la maladie survient chez une femme enceinte au cours de la grossesse, le risque d’une infection du fœtus ne peut pas être exclu.
Un vaccin a été mis au point aux Etats-Unis, mais il est d’une efficacité relative et n’est actif que sur l’espèce Borrelia burgdorferi. Il n’est plus commercialisé à l’heure actuelle.
Ce vaccin n’est pas utilisé en Europe où plusieurs espèces différentes de Borrelia sont présentes.
Vivre avec
Quelles sont les conséquences de la maladie sur la vie familiale, professionnelle, sociale, scolaire, sportive ?
La maladie de Lyme, lorsqu’elle est diagnostiquée précocement et traitée, guérit rapidement et n’a donc pas ou peu de retentissement sur la vie des personnes atteintes. En revanche, si le diagnostic n’est pas fait rapidement et que la maladie devient chronique, le retentissement sur la vie peut être plus important ; les conséquences sont variables en fonction du stade et de la sévérité des symptômes. Les manifestations neurologiques, articulaires, cardiaques peuvent être très handicapantes.
De plus, en raison de la difficulté de diagnostic de cette maladie, les personnes atteintes souffrent souvent d’une non reconnaissance de leur maladie par le système de santé et d’une incompréhension de la part de leurs proches.
Cependant, même au stade tardif de la maladie, le traitement permet habituellement l’amélioration ou la disparition des symptômes.
En savoir plus
Comment entrer en relation avec d’autres personnes atteintes de la même maladie ou pour obtenir plus d’information sur la maladie?
En contactant les associations de malades consacrées à cette maladie. Vous trouverez leurs coordonnées en appelant Maladies Rares Info Services au 0 810 63 19 20 (Numéro azur, prix d’un appel local) ou sur le site Orphanet (www.orphanet.fr).
juillet 2012

 Ces
Ces 
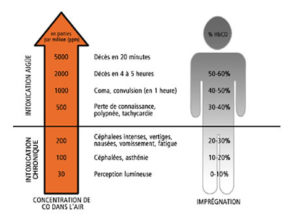 Les signes sont très variés et peuvent évoluer dans le temps.
Les signes sont très variés et peuvent évoluer dans le temps.
 L’ECBU est l’examen de biologie médicale de première intention prescrit par le médecin en cas de suspicion d’infection urinaire ou en contrôle post-antibiothérapie d’une infection urinaire.
Il peut aussi faire partie d’un bilan pré-opératoire ou accompagner, chez l’homme, le dosage du PSA dont le taux pourrait être influencé à la hausse par une éventuelle infection urinaire.
L’ECBU est l’examen de biologie médicale de première intention prescrit par le médecin en cas de suspicion d’infection urinaire ou en contrôle post-antibiothérapie d’une infection urinaire.
Il peut aussi faire partie d’un bilan pré-opératoire ou accompagner, chez l’homme, le dosage du PSA dont le taux pourrait être influencé à la hausse par une éventuelle infection urinaire.
 Les mauvaises habitudes alimentaires représentent une cause majeure dans la formation des calculs calciques, oxaliques et uriques. Les mesures diététiques concernent les boissons et l’alimentation.
Les mauvaises habitudes alimentaires représentent une cause majeure dans la formation des calculs calciques, oxaliques et uriques. Les mesures diététiques concernent les boissons et l’alimentation.
 Ces informations ont été publiées par l’Agence Française de Sécurité Sanitaire des Produits de Santé (AFSSAPS) depuis peu ANSM (Agence Nationale de Sécurité du Médicament et des produits de santé)
Ces informations ont été publiées par l’Agence Française de Sécurité Sanitaire des Produits de Santé (AFSSAPS) depuis peu ANSM (Agence Nationale de Sécurité du Médicament et des produits de santé)
 Cette fiche d’information, rédigée par l’Association Française d’Urologie
Cette fiche d’information, rédigée par l’Association Française d’Urologie  sur la maladie de Lyme. Elle ne se substitue pas à une consultation médicale. Elle a pour but de favoriser le dialogue avec votre médecin. N’hésitez pas à lui faire préciser les points qui ne vous paraîtraient pas suffisamment clairs et à demander des informations supplémentaires sur votre cas particulier. En effet, certaines informations contenues dans cette fiche peuvent ne pas être adaptées à votre cas : il faut se rappeler que chaque patient est particulier. Seul le médecin peut donner une information individualisée et adaptée.
Les informations rapportées ici sont issues de l’Encyclopédie Orphanet Grand Public de mars 2008 –
sur la maladie de Lyme. Elle ne se substitue pas à une consultation médicale. Elle a pour but de favoriser le dialogue avec votre médecin. N’hésitez pas à lui faire préciser les points qui ne vous paraîtraient pas suffisamment clairs et à demander des informations supplémentaires sur votre cas particulier. En effet, certaines informations contenues dans cette fiche peuvent ne pas être adaptées à votre cas : il faut se rappeler que chaque patient est particulier. Seul le médecin peut donner une information individualisée et adaptée.
Les informations rapportées ici sont issues de l’Encyclopédie Orphanet Grand Public de mars 2008 –  La ferritine est la substance chargée du stockage du fer dans l’organisme. Son taux permet de réguler l’absorption intestinale du fer, élément indispensable à la synthèse de l’hémoglobine, principal constituant des globules rouges.
Le dosage sanguin de la ferritine reflète l’état des réserves en fer de l’organisme et permet de surveiller l’efficacité d’un traitement prescrit lors d’une carence ou d’une surcharge en fer.
Variations physiologiques de la ferritine :
Le taux sanguin de la ferritine varie en fonction de l’âge (plus élevé chez les enfants que chez les adultes) et du sexe (plus élevé chez l’homme que chez la femme).
La ferritinémie baisse durant la grossesse et en cas d’exercice physique intensif et régulier.
Les taux normaux sont les suivants :
La ferritine est la substance chargée du stockage du fer dans l’organisme. Son taux permet de réguler l’absorption intestinale du fer, élément indispensable à la synthèse de l’hémoglobine, principal constituant des globules rouges.
Le dosage sanguin de la ferritine reflète l’état des réserves en fer de l’organisme et permet de surveiller l’efficacité d’un traitement prescrit lors d’une carence ou d’une surcharge en fer.
Variations physiologiques de la ferritine :
Le taux sanguin de la ferritine varie en fonction de l’âge (plus élevé chez les enfants que chez les adultes) et du sexe (plus élevé chez l’homme que chez la femme).
La ferritinémie baisse durant la grossesse et en cas d’exercice physique intensif et régulier.
Les taux normaux sont les suivants :